华西口腔周红梅教授团队在口腔鳞癌治疗方面取得重要研究进展
周红梅教授/罗晶晶助理研究员团队在揭示靶向DNMT1实现口腔鳞癌治疗“增效减毒”的表观遗传机制方面取得了新进展,研究成果以“DNMT1-targeting remodeling global DNA hypomethylation for enhanced tumor suppression and circumvented toxicity in oral squamous cell carcinoma”为题发表在国际肿瘤学领域Top期刊Molecular Cancer。周红梅教授和罗晶晶助理研究员为本文通讯作者,刘扬帆博士、孙瑜主治医师和杨津助理研究员为本文共同第一作者。
分子靶向疗法在口腔鳞癌(OSCC)治疗中的应用方兴未艾,但在临床实践中发现单靶点药物常存在耐药,而多靶点联合用药又存在信号串扰、毒副作用叠加等问题。因此,深入探索OSCC生长调控机制并发掘可实现“增效减毒”的关键靶点至关重要。DNA甲基化在恶性肿瘤的发生进展中发挥重要作用。本研究团队前期预测DNA甲基转移酶1(DNMT1)是与OSCC发展密切相关的潜在关键靶点。由于DNMT1在维持癌细胞DNA甲基化稳态中至关重要,因此,干扰其表达或活性很可能扰乱全基因组DNA甲基化,进而引发广泛的下游信号传导障碍。然而,有关DNMT1在OSCC介导的DNA甲基化模式及其调控肿瘤生长的分子机制仍是未解之谜。
本研究通过不同临床队列样本结合多维度生信分析,证实了DNMT1和DNA甲基化状态与口腔黏膜癌变和口腔鳞癌进展密切相关;联合采用DNA甲基化高通量芯片、RNA转录测序、单细胞转录组学、多重组织免疫化学等技术,系统分析了OSCC中DNMT1依赖性全基因组DNA低甲基化稳态,揭示了靶向DNMT1所引发的广泛DNA低甲基化重塑;再进一步整合临床样本、多个细胞株和异种移植瘤动物模型等多模态实验数据,证实了上述新的DNMT1-DNA甲基化作用模式可协同抑制PI3K-AKT和CDK-Rb信号轴传导,实现更显著的肿瘤阻抑效应;结合毒副作用监测及分子免疫学方法,证实DNMT1-DNA甲基化作用模式通过诱导GSK3β失活,巧妙规避了在OSCC治疗中PI3K抑制所致的高血糖和胰岛素反馈毒性反应。
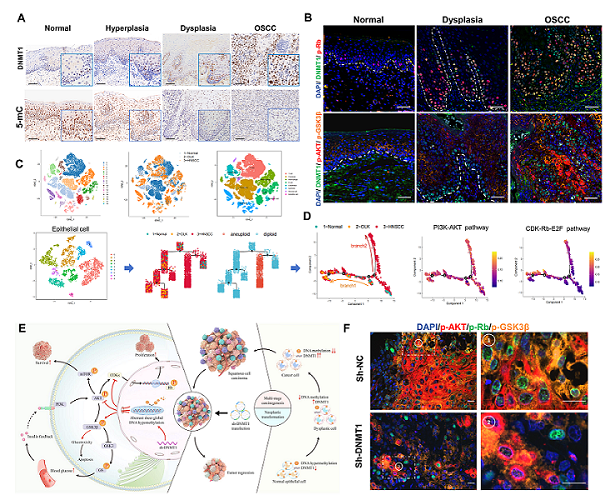
研究结果表明,靶向DNMT1重塑的全基因组DNA低甲基化模式,可通过多信号协同调控机制发挥“增效减毒”效应,从而在OSCC治疗中实现既高效抑癌、又最大限度减少毒性反应。本研究团队阐明了DNMT1作为多信号关键“看门人”(gatekeeper)调控OSCC生长的表观遗传机制,挖掘获得具有重要实用价值的OSCC“致命”靶点。
·转载自四川大学华西口腔医院官网,如有侵权,请联系删除